商品描述:
商品屬性
商品描述:
商品屬性
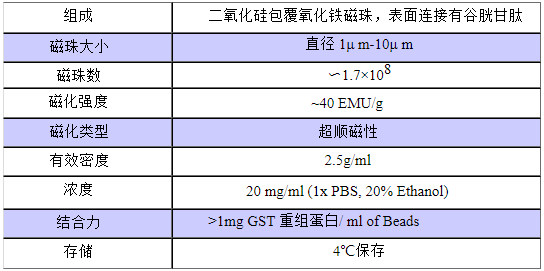
GST Magnetic Beads商品屬性:
產品名稱
規格
貨號
GST Magnetic Beads
1ml(20mg/ml)
BJ-PJ6384
商品介紹:產品介紹:
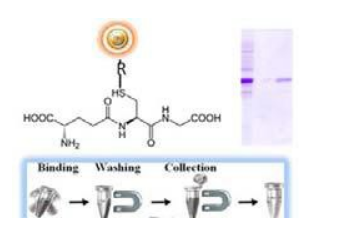
GST Magnetic Beads 是1μm大小均勻的,表面包覆有高密度谷胱甘肽的二氧化硅基質超順磁磁珠。這種磁珠是特定設計主要用于免疫沉淀反應,或者快速,一步法純化帶有 GST-標簽的重組蛋白,純化過程大約需要15-25分鐘。產品特點:
·快捷,簡單的一步法高通量操作,無需純化柱或過濾器,或重復移液、離心等操作(圖 1)
·高結合能力
·極低的非特異性結合率
·成本低:只有市場同類磁珠產品價格的一半
·對樣本體積要求低,便于自動化操作
緩沖液成分:
·GST Magnetic Beads (懸浮在 0.05 M Na2HPO4, pH 7.5, 0.15 M NaCl, 0.01% NaN3 緩沖液
中)
·1x Binding/Washing Buffer (0.14 M NaCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, 2.7 mM KCl, pH 7.5)
·1x Elution Buffer (50 mM Tris-HCl, pH 8.0)
注意事項: Dissolve 100 mg Glutathione (reduced) in 10 ml of 1x Elution Buffer. Prepare fresh. ·PBS Buffer (137 mM NaCl, 2.7 mM KCl, 4.3 mM Na2HPO4, 1.4 mM KH2PO4, pH 7.5)
所需耗材
磁力分離器(適用于手動操作):根據實驗時生物樣品的體積,使用者可以選擇一下不同
型號的磁力分離器:本公司 CZ402-01 可以容納 8 個單獨的 1.5 ml 離心管; CZ402-02 可
以容納 24 個單獨的 1.5 ml 離心管; CZ402-03 和 96 孔深孔板配合使用; CZ402-04 可以容
納 4 個單獨的 15 ml 離心管; CZ402-05 可以容納 4 個單獨的 50 ml 離心管。
操作過程
注意事項:
設計一個用于純化 DNA 或 RNA 的通用操作流程相對簡單,因為核酸具有相對一致
的生化特性。然而,設計一個用于蛋白質純化的通用試劑盒是非常困難的,因為每種蛋白
質具有不同的組成和結構。為了獲得最佳實驗結果,每個用戶必須確定需要純化的融合蛋
白的最佳純化條件。
在純化 GST 標記的融合蛋白之前,應將所需使用的試劑溫度調劑到室溫。
A.細胞提取物的制備
1.將細胞培養液以 10000 x g 離心 6 分鐘,完全去除上清后收集細胞體,并在-80℃下冷凍
放置 1 小時。
2. 在冰塊上解凍細胞,并且每 50 毫升細胞培養物用 3ml 的 1x Binding/ Washing Buffer 重
新懸浮細胞。在冰上通過短暫的超聲破碎細胞,直到樣品不再粘稠。同時避免樣品被加熱。
注意:GST 標簽與磁珠的結合不受 1% Triton X-100、1% Tween-20、1% CTAB、10 mM DTT、
0.03%SDS 或 0.1% NP-40 的影響。而且,這些化學物質可能會減少非特異性結合概率。
3. 以 10000 x g 離心6分鐘,小心地將上清液轉移到干凈的預冷管中,并將沉淀按照每50ml
培養物加入 3ml 1x Binding /Wshing 緩沖液方式重新懸浮。
4. 分別從上清液和沉淀液中吸取 10μl 樣品,加入等體積的 2x SDS 加樣緩沖液, 煮沸 5
分鐘,使用 SDS-PAGE 測定融合蛋白的總量和溶解度。
注意:如果 GST 融合蛋白形成包涵體(不溶性蛋白),則包涵體必須在純化前適當溶解和
重新折疊。
B.在自然條件下純化重組 GST 標簽融合蛋白
1. 震蕩裝有磁珠的試劑瓶,直到磁珠完全懸浮,然后將適量的磁珠轉移到新的試管中。
注意:這一點非常重要,用戶應根據粗樣品中 GST 標記融合蛋白的數量,根據經驗確定
用于每次純化的最佳磁珠數量。過多的磁珠會導致更高的背景;磁珠太少會導致產量下降。
所以,我們建議從每 0.1mg 重組 GST 標簽融合蛋白加 100μl 完全懸浮磁珠開始純化。
2. 將試管置于磁力分離器中,等待 2-3 分鐘,直到上清液完全澄清。吸出上清液,從磁力
分離器上取下管,用 4 倍體積的 1x Binding /Wshing 緩沖液重新懸浮磁珠。
3.重復步驟 2 一次。
4. 將試管放入磁力分離器中,待上清液澄清后丟棄上清液。用 1 倍體積的 1xBinding
/Wshing 緩沖液重新懸浮磁珠。
5. 將制備好的細胞提取物與磁珠混合,通過多次顛倒充分混合,并在連續旋轉的情況下混
勻 10-20 分鐘。將試管放入磁力分離器中,保存一小部分上清液并丟棄剩余部分。
注意:保留一份上清液供進一步分析,因為某些蛋白質可能不會與磁珠結合。
6. 通過添加 8 倍體積的 1x Binding /Wshing 緩沖液清洗磁珠,并通過移液器多次吹吸重新
懸浮磁珠。再次將試管放入磁力分離器中,然后吸出試管上清液。
7. 用 8 倍體積的 1x Binding /Wshing 緩沖液充分清洗磁珠,直到洗脫液在 280 nm 處的
吸光度接近背景水平(OD 280<0.05)。(注意:這一步對于獲得高純度蛋白質非常重要。)
8. 從磁力分離器上取下試管,向試管中加入所需體積的 1x Elution Buffer 緩沖液,從磁珠
上洗脫下結合蛋白。通過多次吹吸,將磁珠重新充分懸浮,并在室溫下渦旋震蕩 5 分鐘充
分混勻。將管放入磁力分離器中,小心地將上清液轉移到干凈的試管中。
9.重復步驟 8 一次。
10. 分別從上述步驟5 中吸取的上清液和步驟 8 中吸取的蛋白洗脫液中吸取 10-20μl 液體,
并進行 SDS-PAGE 分析,以確認目標蛋白的存在。
C.磁珠的再生和儲存
注意:如果目標 GST 融合蛋白相同,則磁珠可重復使用三次而無需再生。但是,如果目
標 GST 融合蛋白不同或磁珠結合能力下降,則必須根據以下條件再生磁珠:
1. 使用 10 倍體積的再生緩沖液 I (50 mM Tris-HCl,pH 8.0, 0.5 M NaCl)清洗磁珠,并用上
述的磁力分離器分離上清液。
2. 使用 10 倍體積的再生緩沖液 II (100 mM 醋酸鈉,pH 4.5, 0.5 M NaCl)清洗磁珠,并用
磁力分離器分離上清液。
3. 通過添加 10 倍體積的 1x Binding /Wshing 緩沖液,快速平衡磁珠。對于長期儲存,磁
珠應儲存在 4ºC 的 20%乙醇中。
D.常見問題
問題 1:純化的融合蛋白產率低或無法檢測到。
可能原因:
1. 重組蛋白形成包涵體
建議: ⑴在 14℃環境培養菌體。
⑵將 IPTG 的最終濃度降低至 0.1mM 以進行蛋白質誘導。 ⑶減少蛋白誘導時間。 ⑷純化前正確破碎包涵體。
2. 該融合蛋白不含有活性 GST 標簽
建議:嘗試使用其他融合蛋白的純化方式,例如 His 標簽。重新編碼目標蛋白的純化標簽。
3.過度的超聲破碎,使蛋白變性。 建議:盡量使用溫和的超聲波條件或其他方法,如溶菌
酶。
4.融合蛋白不與磁珠結合
建議: ⑴在細胞裂解之前,在結合緩沖液中添加最終濃度為 5 mM 的 DTT。 ⑵ 檢查結合緩沖液的 pH 值(pH 值應為 6.5-8.0)。
5. 融合蛋白不能有效地從磁珠中洗脫。
建議: ⑴提高洗脫時間。 ⑵將洗脫緩沖液中的谷胱甘肽濃度增加至 15mM 或更高。(請檢查最終 pH 值,必要時
進行調整。)
⑶在不增加谷胱甘肽濃度的情況下,將洗脫緩沖液的 pH 值調整至 8.0-9.0。 ⑷在洗脫緩沖液中添加最終濃度為 0.1% Triton X-100 或最終濃度為 0.1-0.2 M NaCl。
問題 2. 在洗脫蛋白中觀察到多條帶
可能原因:
1.融合蛋白降解
建議: ⑴添加適量的蛋白酶抑制劑。 ⑵使用蛋白酶缺陷表達宿主。
2. 一些宿主蛋白,如伴侶蛋白,可能與融合蛋白相互作用。
建議: ⑴在洗脫緩沖液中加入最終濃度為 5 mM DTT。 ⑵純化前,在 37℃下將重組蛋白溶液在伴侶蛋白緩沖液(2 mM ATP、10 mM MgSO4、50 mM Tris-HCl)中溫浴 10 min。
3. 過度超聲處理會導致一些蛋白質與融合蛋白結合。